Technical
| Begriff | Definition |
|---|---|
| Negative charge | Biochar has negative charge due to the presence of more -OH functional group and is closely related with pH. As the pH increases, the magnitude of negative charge also increases due to increased deprotonation of the functional group at elevated pH.
Zugriffe - 1580
|
| Neustark | Beton aufwerten und das Klima schonen Dank der Technologie des ETH-Spin-Offs Neustark können Beton-Recyclingwerke Kohlendioxid dauerhaft einlagern. Eigentlich gibt es genug mineralische Stoffe auf der Erde, um mehrere Hundert Milliarden Tonnen Kohlendioxid zu binden, doch weil diese Materialien – etwa Magnesiumsilikate – nicht besonders reaktiv seien, müssten sie zuvor auf 700 Grad aufgeheizt werden, sagt Tiefenthaler. Im Gegensatz dazu habe sich Betongranulat als hochreaktiv erwiesen, wegen der insgesamt riesigen Oberfläche der vielen millimeterkleinen Partikel. Auch ohne Vorbehandlung formt der Betonbruch mit dem Kohlendioxid sehr stabile chemische Verbindungen. Verfeinerte Eigenschaften des Abbruchmaterials Der Clou von Neustarks Technologie: Sie bindet CO2 in den Poren und an der Oberfläche von Betongranulat als Kalkstein. Dieses aufgewertete Granulat kann nun als Sand- und Kiesersatz in frischen Beton gemischt werden. Dank dem aufgewerteten Granulat benötigt man dafür weniger Zement - bei gleichbleibenden Eigenschaften. Doch Gutknecht und Tiefenthaler weisen beide auf einen zusätzlichen Aspekt hin: Mit ihrem Trick, Kohlendioxid aus der Luft zu holen – und es in die Poren des Betongranulats zu stopfen und dort als Kalkstein dauerhaft zu binden, können sie CO2-Emissionen sogar rückgängig machen. «Es gibt nur ganz wenige technische Ansätze für echte negative Emissionen», sagt Tiefenthaler. Die Anwendung dieser Ansätze hält sich bislang in Grenzen, insbesondere weil überzeugende Anreiz- und Geschäftsmodelle fehlen. «In dieser Hinsicht ist unser Vorgehen einmalig, weil wir zeigen, dass sich mit dem Binden von Kohlendioxid ein Mehrwert schaffen lässt. Und dass negative Emissionen nicht nur Kosten, sondern sogar einen wirtschaftlichen Gewinn bringen können», sagt Gutknecht.
aktuell 10 kg/Tonne = 20-24 kg/m3 CO2
Zugriffe - 1545
|
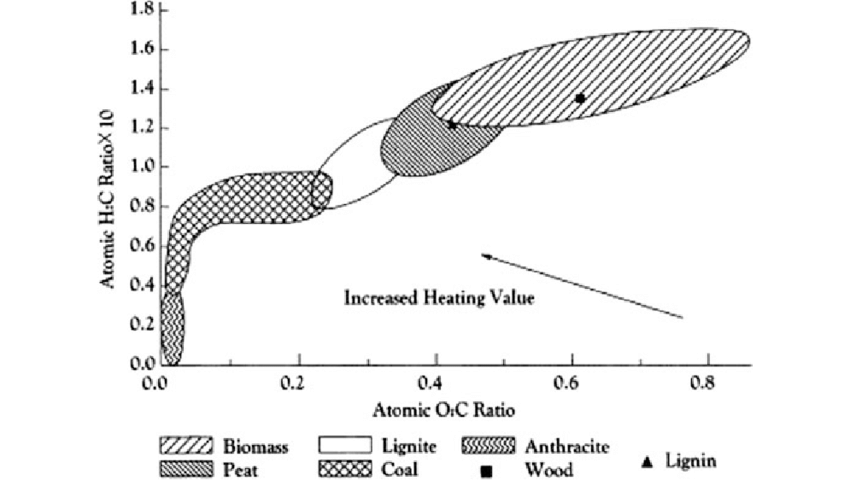
| O/C-H/C-Diagram |
Zugriffe - 1634
|
| Oberflächenbindung | Biokohlen weisen eine große Kapazität zur Sorption, Bindung und Einlagerung von Nährstoffionen sowie anorganischen und organischen Verbindungen auf. Diese resultiert aus ihrer sehr großen inneren und äußeren Oberfläche. Durch Oxidation der Oberflächen entstehen funktionelle Gruppen mit negativem Ladungsüberschuss. Die Sorptionskapazität für Nährstoffkationen wie K+ , Mg2+ oder NH4 + entwickelt sich also in besonderem Maße im Zuge der Alterung frischer Biokohlen oder durch spezielle Maßnahmen bei der Herstellung (z.B. Aktivierung mit Wasserdampf).
Zugriffe - 1615
|
| Oberflächenoxidation | Die Oxidation der Oberflächen frischer Biokohlen im Zuge ihrer Alterung führt zur Bildung einer Vielzahl funktioneller Gruppen, welche ihre Reaktivität bedingen (Hammes und Schmidt 2009). Im Allgemeinen handelt es sich um Carboxyl-, Phenol-, Carbonyl-, Hydroxyl- oder Ami-nogruppen. Diese Gruppen bestimmen die chemischen Wirkungen der Kohlen, die sowohl als Katalysator als auch als Reagenz fungieren können. Gleichzeitig nimmt die negative Ladung der Oberflächen zu (Cheng et al. 2006 und 2008a, Hilscher et al. 2009, Liang et al. 2006). Dies führt zu einer Zunahme der Kationenaustauschkapazität. Damit können Nährstoffe in größerem Maße gebunden werden und für Pflanzen und Mikroorganismen über einen längeren Zeit-raum verfügbar bleiben. Aufgrund ihrer Polarität wirken sich hydrophile Gruppen (amino, carboxyl, keto …) auch auf die Wasserhaltekapazität des Bodens aus (Sevilla et al. 2011, Spokas et al. 2012a) und erhöhen die Wasserlöslichkeit und den Transport der Biokohlen mit dem Si-cker- und Oberflächenwasser (Glaser et al. 2002a, Hilscher und Knicker 2011, Rumpel et al. 2006a, Wiesmeier et al. 2009). Neben den organischen Verbindungen enthalten die Biokohlen auch anorganische Verbindun-gen, die in ihrer Gesamtheit als „Asche“ bezeichnet werden. Hierzu zählen metallische Oxide wie Al2O3, CaO, MgO, MnO2, Fe2O3, Na2O, oder K2O und nichtmetallische Oxide wie SiO2, SO3 und P2O5 (Brewer et al. 2009), die leicht ausgewaschen werden können (Yao et al. 2010).
Zugriffe - 1548
|
| Oelverschmutzung | Oil spills cause massive loss of aquatic life. Oil spill cleanup can be very expensive, have secondary environmental impacts, or be difficult to implement. This study employed five different adsorbents: (1) commercially available byproduct Douglas fir biochar (BC) (SA ∼ 695 m2/g, pore volume ∼ 0.26 cm3/g, and pore diameter ∼ 13–19.5 Å); (2) BC modified with lauric acid (LBC); (3) iron oxide-modified biochar (MBC); (4) LBC modified with iron oxide (LMBC); and (5) MBC modified with lauric acid (MLBC) for oil recovery. Transmission, engine, machine, and crude oils were used to simulate oil spills and perform adsorption experiments. All five adsorbents adsorbed large quantities of each oil in fresh and simulated seawater with only a slight pH dependence, fast kinetics (sorptive equilibrium reached before 15 min), and high regression fits to the pseudo-second-order kinetic model. The Sips isotherm model oil sorption capacities for these sorbents were in the range ∼3–11 g oil/1 g adsorbent. Lauric acid-decorated (60–2 wt %) biochars gave higher oil adsorption capacities than the undecorated biochar. Lauric acid enhances biochar hydrophobicity and its water contact angle and reduces water influx into biochar’s porosity preventing it from sinking in water for 3 weeks. These features were observed even at 2% wt of lauric acid (sinks only after 2 weeks). Magnetization by magnetite nanoparticle deposition onto BC and LBC allows the recovery of the exhausted adsorbent by a magnetic field as an alternative to filtration. Oil sorption was endothermic. Recycling was demonstrated after toluene stripping. The oil-laden adsorbents’ heating values were obtained, suggesting an alternative use of these spent adsorbents as a low-cost fuel after recovery, avoiding waste disposal costs. The initial and oil-laden adsorbents were characterized by scanning electron microscopy, transmission electron microscopy, energy-dispersive X-ray spectroscopy, Fourier transform infrared spectroscopy, X-ray diffraction, Brunauer–Emmet–Teller surface area, contact angle, thermogravimetric analyses, differential scanning calorimetry, vibrating sample magnetometry, elemental analysis, and X-ray photoelectron spectroscopy.
Zugriffe - 1656
|
| Ölschiefer | Als Ölschiefer werden dunkelgraue bis schwarze, tonig und mergelige Sedimentgesteine bezeichnet, die bis zu 20 %, in einigen Vorkommen bis 30 % Kerogen, eine Vorstufe von Erdöl, enthalten. Die Kerogene werden durch Erhitzen auf 340 bis 530 °C in rohölähnliche Substanzen (Schiefer- oder Schwelöl) und Gas umgewandelt.[1][2] Ölschiefer ist nach heutiger petrographisch korrekter Bezeichnung kein Schiefer im eigentlichen Sinne, sondern ein geschichtetes, aber nicht geschiefertes Sedimentgestein. Die Kerogene bilden sich unter Sauerstoffabschluss aus abgestorbenem Plankton, Meerwasser- und Süßwasseralgen sowie Bakterien. Bei chromatographischen Untersuchungen lassen sich Aminosäuren und Chlorophyll-Abbauprodukte feststellen. Unter bestimmten geologischen Bedingungen können sich aus Ölschiefern im Laufe der Erdgeschichte durch zunehmende Überlagerung und Temperaturerhöhung Erdölmuttergesteine bilden. Ölschiefer gehört zu den sogenannten „unkonventionellen Vorkommen“, deren Ausbeutung aufgrund sehr hoher Förderkosten noch nicht lohnend ist.
Zugriffe - 1499
|
| Organische Verbindungen | Molekulare Verbindungen, in denen Kohlenstoff in Verbindung mit Wasserstoff enthalten ist, werden als „organisch“ bezeichnet. Sie bilden den weitaus größten Teil aller chemischen Verbindungen und leiten sich vom Methangas, der Gruppe der Alkane bzw. den Kohlenwasserstoffen ab. Im Kohlenwasserstoffgerüst organischer Verbindungen befinden sich oft weitere Atomgruppen, die die Eigenschaften der organischen Verbindung beeinflussen. Dem Kohlenstoffgerüst entsprechend werden organische Verbindungen unterteilt in:
Zugriffe - 1616
|
| Oxdiation | Eine Oxidation ist eine chemische Reaktion, bei der ein Stoff eine bestimmte Anzahl von Elektronen abgibt. Dabei wird der Stoff oxidiert. Du nennst ihn Elektronendonator. Ein anderer Stoff, der Elektronenakzeptor genannt wird, nimmt die Elektronen auf und wird dabei reduziert. Beide Teilreaktionen laufen immer zusammen ab. Du bezeichnest das als Redoxreaktion .
Zugriffe - 1596
|
| Oxonium | Oxonium (auch: Oxonium-Ion, veraltet, aber verbreitet: Hydroxonium und Hydronium, nach IUPAC streng systematisch, aber ungebräuchlich: Oxidanium[1]) ist die Bezeichnung für ein protoniertes Wassermolekül (H3O+). In der Regel werden auch hydratisierte Ionen wie H9O4+ (H3O+ · 3 H2O) als Oxonium- oder Hydroxonium-Ionen bezeichnet. Ladungsträger ist im Wesentlichen das Sauerstoffatom und es handelt sich um ein Kation, was sich aus dem Wort Oxonium ableiten lässt, da Ox(o)... für Sauerstoffatom und ...onium für ein Kation[2] steht. Oxonium bildet sich durch protolytische Reaktionen in Wasser bzw. in wässrigen Lösungen. Im weiteren Sinn sind Oxonium-Ionen eine Sammelbezeichnung für organische Abkömmlinge des Ions H3O+ in der Form [R−OH2]+ [R2OH]+ [R3O]+, wobei R für organische Reste steht.[3][4] Auch bei diesen Kationen tragen Sauerstoffatome die Ladung. Liegen Oxonium (H3O+) oder seine organischen Abkömmlinge als Kation eines Salzes vor, zählt man die Verbindungen zu den Oxoniumsalzen. Liegt Hydronium (auch: Hydronium-Ion) als hydratisiertes H+-Teilchen vor, werden oft aus Gewohnheit bzw. aus Bequemlichkeit die Bezeichnungen H+, H+aq oder H+ · H2O gewählt. Gemeint sind jedoch in der Regel H3O+-Teilchen. Die Bezeichnung Hydronium und das Teilchen H+ sind für die Formulierung von chemischen Reaktionen nur wenig geeignet, da ein Hydron (das H+-Teilchen, auch Proton genannt) in freier Form in Lösungen oder in Verbindungen nicht existiert, sondern sich sofort mit dem nächstbesten Molekül verbindet und daher allein weder Reaktant noch Produkt einer Reaktion ist.
Zugriffe - 1604
|
| Partikelgrösse/Poren/Wasser | The results clearly showed that both biochar intraporosity (pores inside biochar particles) and interporosity (pore spaces between biochar and soil particles) are important factors affecting amended soil hydraulic proper- ties. Biochar interpores affected mainly hydraulic conductivity; both interpores and intrapores controlled soil water retention properties. Our results suggest that for a more effective increase in soil water retention of coarse soils, the use of hydrophilic biochar with high intraporosity is recommended. Highlights • Biochar increases soil water retention and reduces hydraulic conductivity. • Hydrophobicity of biochar increased with decreasing particle size. • Coarse biochar particles increased soil water retention due to hydrophilic surfaces and increased intraporosity.
Zugriffe - 1659
|
| Peroxidasen | Peroxidasen sind Enzyme, welche die Reduktion von Peroxiden (meist Wasserstoffperoxid) katalysieren. Die Reaktion dient hauptsächlich der Entfernung der giftigen Peroxide, aber auch zur Oxidation von Iodid bei der Synthese des Schilddrüsenhormons Thyroxin im Menschen. Die Umkehrreaktion der Katalase wird dagegen in manchen Peroxidasen zur Erzeugung von Wasserstoffperoxid genutzt. Peroxidasen sind in allen Lebewesen zu finden, beim Menschen sind 17 solcher Enzyme entdeckt, von denen bei fünf erbliche Enzymmangelkrankheiten bekannt sind (DUOX2, MPO, TPO, EPX, CAT).[1] Als Reduktionsmittel dienen unterschiedliche Elektronendonatoren (in Klammern angefügt), wonach die weitere Einteilung erfolgt: Katalase (ein zweites Molekül Wasserstoffperoxid), Cytochrom-c-Peroxidase (red. Cytochrom c), Thyreoperoxidase (Iodid), Glutathionperoxidase (Glutathion), die nur in Pflanzen vorkommende Ascorbatperoxidase und die in Pilzen vorkommenden Manganperoxidase (Mangan(II)) und Ligninase (Lignin abbauendes Enzym).[2][3][4][5][6] Soll Wasserstoffperoxid erzeugt werden, wird einerseits die Umkehrung der Katalasefunktion, andererseits die Reduktion von Sauerstoff mit NADPH (duale Oxidase) genutzt.
Zugriffe - 1682
|
| Pestizid/Herbizid | Was ist der Unterschied zwischen Herbizid und Pestizid?
Der Hauptunterschied zwischen Pestiziden und Herbiziden besteht darin, dass ein Pestizid im Allgemeinen verwendet wird, um Schädlinge aller Art, einschließlich Insekten und gelegentlich Pflanzen, abzutöten oder abzuwehren, und ein Herbizid ist normalerweise dazu bestimmt, bestimmte Pflanzenarten wie Unkräuter und ...
Zugriffe - 1614
|
| PK in Beton | Hohe Temperaturen und Zeitdauer: Volatile Teile und funktionelle Gruppen werden in Richtung anorganischem Kohlenstoff abgebaut. Die mechanischen Eigenschaften verbessern sich. Zugabe von 10% Asche verbessert die Druckfestigkeit, Dauerhaftigkeit und Bearbeitung. Die hohe Ionen-Austauschfähigkeit der Kohle schafft neue Verbindungsvarianten zu den Zementstoffen und mineralischen Komponenten. Pyrolysekohle gemahlen schafft auch durch ihre poröse, grosse Oberfläche Grenzflächen für die Bindung der Zementmatrix. Als Füller reduziert sie Hohlräume und bindet Porenwasser.
Zugriffe - 1599
|
| Polar/Unpolar | Polarität bezeichnet in der Chemie die Bildung getrennter Ladungsschwerpunkte in Atomgruppen aufgrund von Ladungsverschiebungen; dadurch sind die Atomgruppen nicht mehr elektrisch neutral. Das elektrische Dipolmoment ist ein Maß für die Polarität eines Moleküls und bestimmt die Löslichkeit eines Stoffs oder seine Fähigkeit, als Lösungsmittel zu wirken:
Ein Lehrsatz der mittelalterlichen Alchemie war: „Similia similibus solvuntur“ (lat.: „Ähnliches löst sich in Ähnlichem“). Aufgrund ihrer Ionenstruktur sind viele Salze im polaren Lösungsmittel Wasser gut löslich, unpolare Stoffe wie Fette oder Wachse dagegen nicht. Auch viele Aroma- und Duftstoffe sind in Wasser nicht, in Öl oder in Ethanol aber gut löslich. Alkohol ist daher in vielen fettarmen Lebensmitteln als Zutat aufgeführt.
Zugriffe - 1757
|